
 762
762 收藏
收藏
北京化工大学攻读硕士学位研究生入学考试《有机化学》样题
注意事项
1) Les réponses doivent être rédigées sous forme de phrases, de façon claire et concise.
2) Les réponses doivent être justifiées.
3) Aucun document n'est autorisé. La calculatrice est autorisée.
Partie I. Synthèse de la citréoviridine
Les intoxications alimentaires sont provoquées par des moisissures toxiques. La toxine citréoviridine se forme sur le riz, sa structure est proposée ci-dessous (Figure 1):
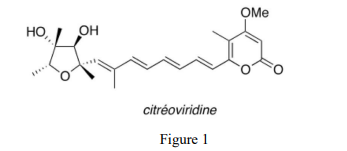
Nous étudions la synthèse asymétrique de la citréoviridine décrite par le groupe de Williams (The Journal of Organic Chemistry 1987, 52, 5067–5079) à partir du précurseur chiral 1 via les intermédiaires 9 et 16 (Figure 2) :
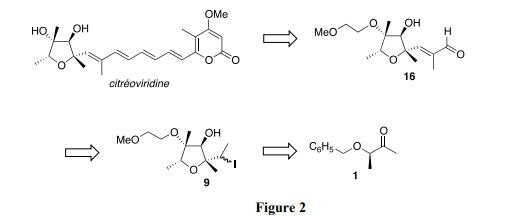
La synthèse de l’intermédiaire 16 est effectuée à partir du composé 9 en six étapes représentées sur la Figure 3 :
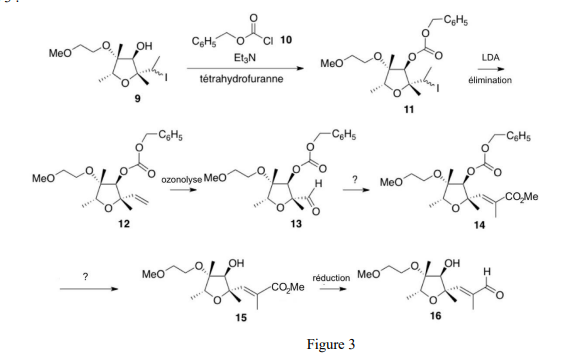
Le composé 9 réagit avec le chlorure de benzyloxyméthanoyle 10 en présence de triéthylamine (Et3N) dans le THF et conduit à la formation du produit 11. Le composé 11 réagit avec LDA (base forte non nucléophile) pour former le produit 12. Le composé 12 subit une ozonolyse pour former le produit 13. Formation du produit 11
Q4. Justifier le choix du chlorure d’acide 10 pour préparer le produit 11 à partir du composé 9.
Q5. Indiquer le rôle joué par Et3N et THF dans cette transformation.
Q6. Écrire le mécanisme réactionnel de la formation du produit 11.
Formation du produit 14
Q7. Nommer la réaction qui permet de former le composé 14 à partir de l’aldéhyde 13.
Q8. Proposer un réactif pour cette réaction. Justifier son caractère nucléophile.
Q9. Donner une méthode de préparation de ce réactif.
Formation du produit 15
Q10. Proposer une méthode pour former le produit 15 à partir du composé 14.
Q11. Nommer cette étape.
Formation du produit 16
La réduction de la fonction ester 15 conduit à former l’intermédiaire 16.
Q12. Expliquer la stratégie de synthèse organique pour former l’intermédiaire 16 à partir du composé 9.
Partie II. Époxydation – Hydrolyse Basique
Formation de l’époxyde
On réalise dans l’étape 1 l’époxydation du (E) but-2-ène et on obtient un mélange d’époxydes.
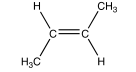
Q13. Indiquer les conditions expérimentales pour la synthèse d’un époxyde à partir d’un alcène.
Q14. Expliquer pourquoi le mélange d’époxydes ne contient pas tous les stéréoisomères.
Q15. Représenter les stéréoisomères formés et indiquer la relation de stéréoisomérie entre eux.
Formation du diol
On réalise dans l’étape 2 l’hydrolyse basique de l’époxyde suivant :
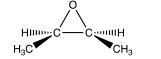
Q16. Préciser la chiralité (chiral ou achiral) de cet époxyde. Justifier la réponse.
Q17. Déterminer le nombre de pics, l’intégration et la multiplicité observés sur le spectre RMN 1H de cet époxyde.
Q18. Expliquer la différence principale observée entre le spectre IR (infrarouge) de l’époxyde et du diol.
Q19. Proposer un mécanisme pour former le diol.
Q20. Représenter les produits formés et déterminer la configuration des centres stéréogènes.
Q21. Conclure sur la stéréospécificité de l’étape 2
研晟考研,专注清华北大等985/211名校考研辅导,拥有完善的服务团队,专属定制化的考研备考规划,力争实现每位学子的考研梦、名校梦